【もう迷わない!】質量パーセント濃度とモル濃度を自由自在に変換する化学のレシピ(規定度N・ppm)
サイエンストレーナーの桑子研です。毎日が実験。
料理のレシピで「塩少々」と書かれていると、一体どれくらい?と迷ったことはありませんか?実は、化学の世界でも同じような「濃さ」の表し方がいくつかあり、科学者たちは場面によって使い分けています。今回は、理科の実験でおなじみの「質量パーセント濃度」と、より専門的な「モル濃度」という、二つの「濃さ」の単位を行き来する方法を探検してみましょう。この計算がわかると、化学の世界がぐっと身近に感じられ、実験がもっと楽しく、安全になりますよ!
なお、実際の希釈の方法については、こちらをご覧ください。
濃度の基本:単位の違いを理解しよう
中学校の教科書では「質量パーセント濃度」がよく使われますが、実験マニュアルや論文では「モル濃度」が主流です。そこで、この二つの濃度を自由自在に変換する方法をマスターしましょう。計算方法がわかっていると、とても便利で、何より安心ですよね。
質量パーセント濃度も、モル濃度も、基本の考え方は同じです。
溶質(溶けているもの) ÷ 溶液(全体)
違うのは、その「単位」だけ。質量パーセント濃度は質量(g)で考えます。
溶質(g)÷ 溶液(g)
一方、モル濃度は化学反応の粒の数に注目したモル(mol)と、体積(L)を使います。
溶質(mol)÷ 溶液(L)
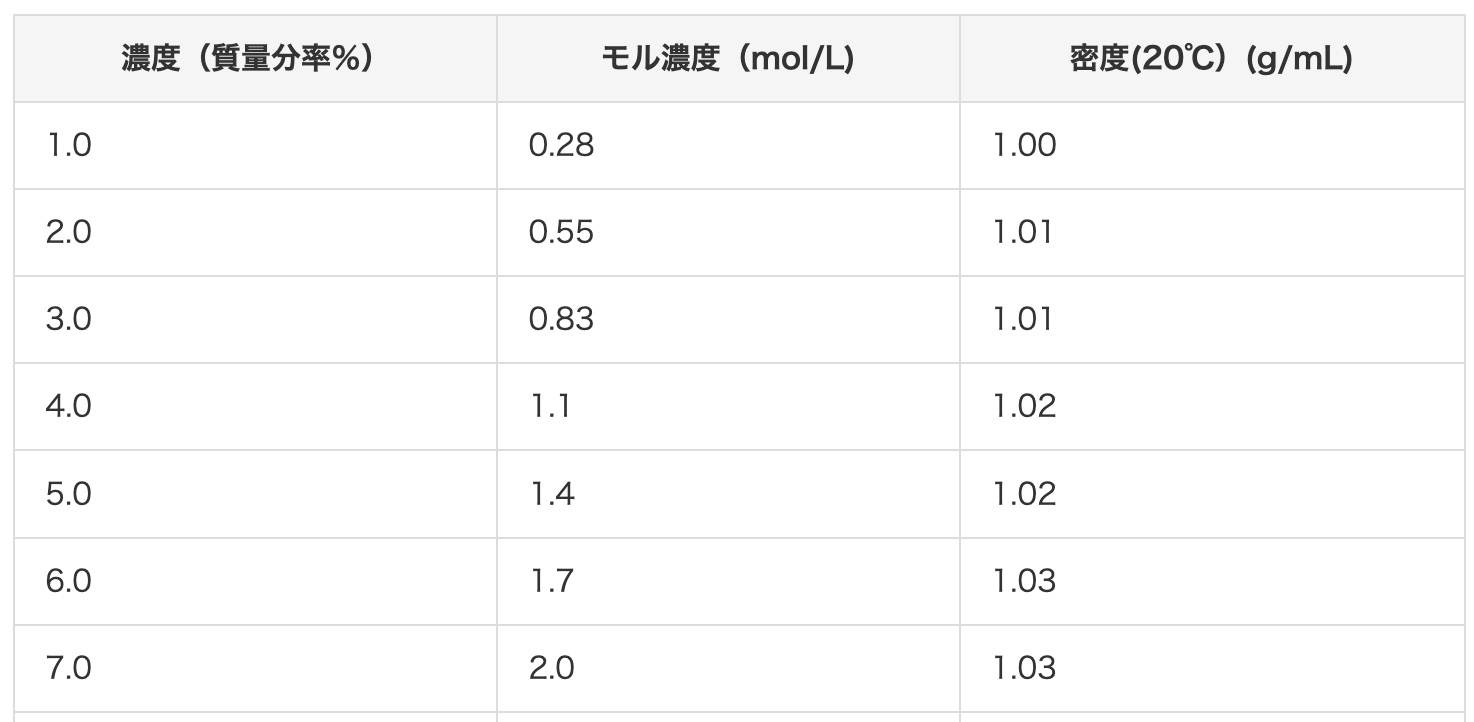
それでは、具体的に2 mol/Lの塩酸を質量パーセント濃度に変換してみましょう。こちらのサイトの早見表で答えを確認すると、2 mol/Lの塩酸は、およそ7%になるようです。本当にそうなるか、計算で確かめてみましょう!
実践!モル濃度から質量パーセント濃度へ
まず、計算に必要な情報を集めます。塩酸(HCl)の分子量:原子の重さを足します。水素(H)が1、塩素(Cl)が35.5なので、1 + 35.5 = 36.5 です。塩酸(2mol/L)の密度:情報によると1.03 g/cm³です。これは、1 cm³あたり1.03 gの重さがあることを意味します。
では、溶液1 Lを基準に計算してみましょう。
溶質:2 mol ⟶ 2 × 36.5 = 73 g
溶液:1 L = 1000 cm³ ⟶ 1000 × 1.03 g/cm³ = 1030 g
溶液1 L(1030 g)あたり、塩化水素が73 g溶けていることがわかりました。これを質量パーセント濃度の式にあてはめると…
73 (g) ÷ 1030 (g) = 0.070… つまり、約7%!
見事に早見表の値と一致しましたね!
逆もやってみよう!質量パーセント濃度からモル濃度へ
今度は逆の計算に挑戦です。単位を一つずつ変換していけば、必ず元に戻せます。例えば、塩酸7%、密度1.03 g/mL という条件でモル濃度を求めてみましょう。モル濃度は「溶液1 Lあたりに溶質が何mol溶けているか」がポイントです。
まず、溶液1 Lの重さを計算します。
溶液 1 L = 1000 mL ⟶ 1000 mL × 1.03 g/mL = 1030 g
このうちの7%が溶質(塩化水素)の重さなので、
溶質 1030 g × 0.07 = 72.1 g
最後に、この溶質の重さをモルに変換します。塩化水素の分子量36.5で割ると、
72.1 (g) ÷ 36.5 (g/mol) ≒ 1.97 (mol)
溶液1 Lあたり1.97 mol溶けているので、濃度は約2 mol/Lとなります。こちらもバッチリですね!
便利な計算ツール
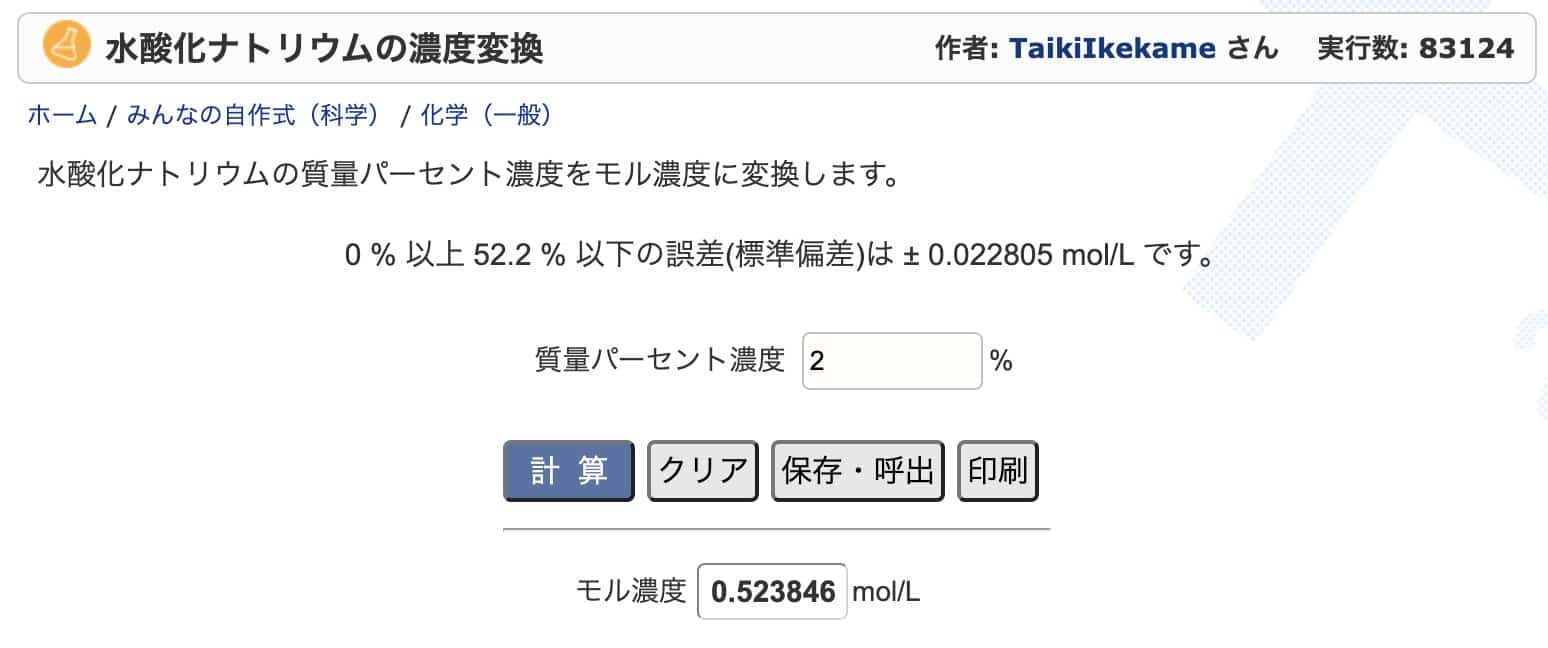
よく使う薬品である塩酸と水酸化ナトリウムについては、濃度変換ソフトを作ってくださった方がいるようです。こちらで検算してみるのも良いでしょう。
https://keisan.casio.jp/menu/person/TaikiIkekame
例えば塩酸の場合、こちらのサイトで「7%」と入力して計算すると、「1.981 mol/L」とすぐに正確な値が出てきます。
https://keisan.casio.jp/exec/user/1480248881

【豆知識①】塩酸と塩化水素、どう違う?
よく混同されがちですが、「塩化水素(HCl)」は常温では気体です。その塩化水素が水に溶けたもの(水溶液)を「塩酸」と呼びます。実は私たちの胃の中にある胃酸も、この塩酸が主成分で、食べ物の消化を助けてくれているんですよ。決して、「塩化水素HCl=塩素Cl」ではないので、注意しましょう。
【豆知識②】規定度(N)とは?
「規定度(N)」という単位も存在します。これはモル濃度に、その酸やアルカリが持つ「パワーの数(価数)」を掛けたものです。例えば塩酸(HCl)はパワーが1(1価)なので、1 mol/Lなら規定度も1 Nです。一方、硫酸(H₂SO₄)はパワーが2(2価)なので、1 mol/Lなら規定度は2 Nとなります。酸やアルカリの反応の強さを直感的に比較したいときに便利な単位です。詳しくはこちらをご覧ください。
【豆知識③】ppmってどれくらい?
「ppm」は「100万分の1」を意味する単位で、”parts per million”の略です。パーセントが100分率なのに対し、ppmは100万分率。非常に小さな濃度を表すときに使われます。
溶質の質量(mg) / 溶液の質量(kg)
溶液1 kg(1000 g)の中に、わずか1 mgの溶質が溶けている状態が1 ppmです。

これがどれくらい小さいかというと…
- 1トンの重さの中の、たった1 g
- 100万円の中の、たった1円
- ある研究会で聞いた話では、お年玉年賀状の1等が当たる確率が、だいたい1 ppmなのだとか!(調べてみました)
こう考えると、ppmがとてつもなく小さな割合であることが実感できますね。
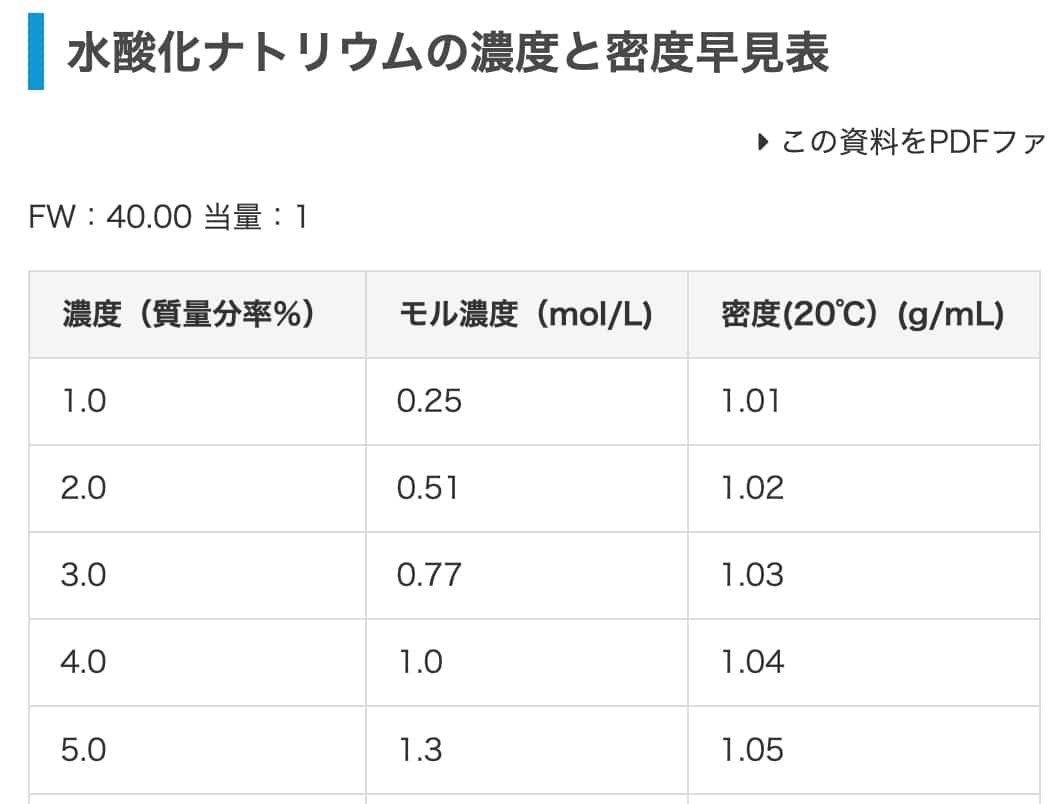
練習問題:水酸化ナトリウムで換算してみよう
最後に、水酸化ナトリウムで練習してみましょう。2%の水酸化ナトリウム水溶液をモル濃度に換算します。こちらの表を参考にすると、密度は1.02 g/mL(記事の1.03g/mLは塩酸の値のようですので、こちらで計算します)。答えは0.51 mol/Lになるはずです。
まず、溶液1 Lの質量を計算します。
1000 mL × 1.02 g/mL = 1020 g
この2%が溶質の量なので、
1020 g × 0.02 = 20.4 g
これをモルに変換します。水酸化ナトリウム(NaOH)の分子量は40なので、
20.4 g / 40 (g/mol) = 0.51 mol
となり、1Lあたり0.51 molなので、モル濃度は0.51 mol/L。見事、表の値と一致しました!
こちらのサイトで計算をしてみても、ほとんど一致します。
水酸化ナトリウムの濃度変換:https://keisan.casio.jp/exec/user/1480256880
参考
中学校で使うことが多い塩酸は、濃塩酸を一気に薄めて使うと便利です。例えば、10%の塩酸を作るには、体積比で濃塩酸1に対して水を3.2加えます。500 cm³の濃塩酸を全て10%にするには、1600 cm³の水で薄めれば良いので、3リットルのポリエチレンの容器(amazon)などに薄めて保管すると良いでしょう。
|
|
お問い合わせ・ご依頼について
科学の不思議やおもしろさをもっと身近に!自宅でできる楽しい科学実験や、そのコツをわかりやすくまとめています。いろいろ検索してみてください!
・運営者・桑子研についてはこちら
・各種ご依頼(執筆・講演・実験教室・TV監修・出演など)はこちら
・記事の更新情報はXで配信中!
![]() 科学のネタチャンネルでは実験動画を配信中!
科学のネタチャンネルでは実験動画を配信中!

![[商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。] [商品価格に関しましては、リンクが作成された時点と現時点で情報が変更されている場合がございます。]](https://hbb.afl.rakuten.co.jp/hgb/2c6a2576.25faaa1b.2c6a2577.0abda625/?me_id=1240371&item_id=10000489&pc=https%3A%2F%2Fthumbnail.image.rakuten.co.jp%2F%400_mall%2Fnagamineshouten%2Fcabinet%2Fporikan%2F3-1.jpg%3F_ex%3D80x80&s=80x80&t=picttext)

